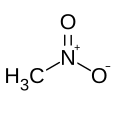
Nitrometan
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny | CH3NO2 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 61,04 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | przezroczysta, bezbarwna, oleista ciecz[1] | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | 75-52-5 | ||||||||||||||||||||||||||||||||
| PubChem | 6375 | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Podobne związki | nitroetan, tetranitroetan, tetratlenek diazotu, etan | ||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Nitrometan – organiczny związek chemiczny posiadający grupę nitrową, używany jako składnik paliw modelarskich, lotniczych i rakietowych paliw silnikowych. Jego obecność w benzynie powoduje wzrost mocy silnika w porównaniu ze stosowaniem zwykłej benzyny.
Nitrometan jest szczególnie popularny w mieszankach paliwowych dla modelarzy. Paliwa te zawierają od 1 do 40% nitrometanu, metanol oraz mieszankę olejów smarujących.
Otrzymywanie
Nitrometan można otrzymać m.in. w reakcji bromku lub jodku metylu z azotynem srebra (metoda Meyera stosowana do otrzymywania nitroparafin oraz nitroolefin typu allilowego) w niepolarnych mediach (eter dietylowy, pentan, heksan). W niskich temperaturach głównym produktem jest nitrometan. Wzrost temperatury stymuluje powstawanie azotynu alkilowego:
- 2CH
3X + 2AgNO
2 → CH
3NO
2 + CH
3ONO + 2AgX↓
Inną możliwością jest wykorzystanie metody Cornbluma będącej modyfikacją procesu opisanego wyżej. W reakcji tej w roli generatora jonów azotynowych stosuje się azotyn sodu. Reakcja w odróżnieniu od procesu Meyera biegnie w układzie homogenicznym i silnie polarnych rozpuszczalnikach (DMSO, DMF). Chociaż wydajność procesu jest niższa, to znacznie niższy koszt azotynu sodu kompensuje tę niedogodność.
Kolejną metodą otrzymywania jest reakcja kwasu chlorooctowego z azotynem sodowym w środowisku zobojętnionym NaOH wobec fenoloftaleiny. Podczas destylacji otrzymuje się mieszaninę wody i nitrometanu, który oddziela się i ponownie destyluje.
- ClCH
2COOH + NaNO
2 + NaOH → CH
3NO
2 + NaCl + NaHCO
3
Przypisy
- ↑ a b c d Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4 .
- ↑ a b c d e f g h Nitromethane, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 38500 [dostęp 2023-08-22] (niem. • ang.).
- ↑ CRC Handbook of Chemistry and Physics, William M.W.M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 5-94, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Nitromethane, karta charakterystyki produktu Sigma-Aldrich, Merck, 15 czerwca 2023, numer katalogowy: 230731 [dostęp 2023-08-22] . (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)