Hydroksyaceton
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||
| Wzór sumaryczny | C3H6O2 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 74,08 g/mol | |||||||||||||||||||||||||
| Wygląd | bezbarwna, gęsta ciecz[1] | |||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||
| Numer CAS | 116-09-6 | |||||||||||||||||||||||||
| PubChem | 8299 | |||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Hydroksyaceton, acetol – organiczny związek chemiczny z grupy α-hydroksyketonów (α-ketoli). Jest pochodną acetonu zawierającą grupę hydroksylową przy atomie węgla 1.
Występowanie
Występuje naturalnie jako metabolit m.in. człowieka, myszy czy bakterii E. Coli[2]. Jest produktem pośrednim w metabolizmie glicyny, seryny i treoniny[3].
Otrzymywanie
Można otrzymać go np. przez:
- dehydratację gliceryny w obecności katalizatora kwasowego[6]:
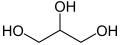

 + H
+ H
2O
- reakcję bromoacetonu z mrówczanem sodu lub potasu bądź z octanem sodu lub potasu, a następnie hydrolizę tak otrzymanego estru z użyciem metanolu[7]
Zastosowanie
Stosowany jest jako reduktor, m.in. w przemyśle tekstylnym w procesach barwienia (zastępuje sukcesywnie inne związki ze względu na łatwość degradacji), w przemyśle spożywczym jako środek zapachowy do żywności, składnik samoopalaczy, a także w syntezie organicznej, np. do otrzymywania acetonu, glikolu propylenowego, aldehydu propionowego lub pochodnych furanu[6], a także diacetylu (w wyniku kondensacji z formaldehydem)[8].
Zobacz też
Przypisy
- ↑ a b c d e f g h i j k l Hydroxyacetone, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 032470 [dostęp 2019-12-05] (niem. • ang.).
- ↑ hydroxyacetone, [w:] Chemical Entities of Biological Interest, European Bioinformatics Institute, CHEBI:27957 [dostęp 2019-12-05] (ang.).
- ↑ Hydroxyacetone, [w:] Human Metabolome Database, Genome Canada, HMDB0006961 [dostęp 2019-12-05] (ang.).
- ↑ Ron M.R.M. Painter Ron M.R.M., David M.D.M. Pearson David M.D.M., Robert M.R.M. Waymouth Robert M.R.M., Selective Catalytic Oxidation of Glycerol to Dihydroxyacetone, „Angewandte Chemie International Edition”, 49 (49), 2010, s. 9456–9459, DOI: 10.1002/anie.201004063 (ang.).
- ↑ HardoH. Siegel HardoH., ManfredM. Eggersdorfer ManfredM., Ketones, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 15, DOI: 10.1002/14356007.a15_077 (ang.).
- ↑ a b Tiago PinheiroT.P. Braga Tiago PinheiroT.P., NadineN. Essayem NadineN., AntoninhoA. Valentini AntoninhoA., Synthesis of Cu–MxOy/Al2O3 (M = Fe, Zn, W or Sb) catalysts for the conversion of glycerol to acetol: effect of texture and acidity of the supports, „RSC Advances”, 5 (113), 2015, s. 93394–93402, DOI: 10.1039/C5RA16166E (ang.).
- ↑ P.A.P.A. Levene P.A.P.A., A.A. Walti A.A., Acetol, „Organic Syntheses”, 10 (1), 1930, DOI: 10.15227/orgsyn.010.0001 .
- ↑ HerbertH. Leube HerbertH. i inni, Textile Dyeing, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 60, 65, 125, 128, DOI: 10.1002/14356007.a26_351 (ang.).


















