Kwas chlorowy
| |||||||||||||||||||||
| |||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||
| Wzór sumaryczny | HClO | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | HOClO | ||||||||||||||||||||
| Masa molowa | 84,46 g/mol | ||||||||||||||||||||
| Wygląd | występuje jedynie w roztworach wodnych[2] | ||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||
| Numer CAS | 7790-93-4 | ||||||||||||||||||||
| PubChem | 19654 | ||||||||||||||||||||
| DrugBank | DB14150 | ||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Inne aniony | HNO | ||||||||||||||||||||
| Podobne związki | HClO, HClO | ||||||||||||||||||||
| Pochodne | chlorany, np. chloran potasu | ||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||
| |||||||||||||||||||||
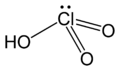
Kwas chlorowy (nazwa Stocka: kwas chlorowy(V)), HClO
3 – nieorganiczny związek chemiczny z grupy kwasów tlenowych. Istnieje wyłącznie w postaci roztworów wodnych o maksymalnym stężeniu 40% (m/V)[3].
Właściwości
Jest to kwas o dużej mocy, o silnych właściwościach utleniających. W kontakcie ze śladowymi ilościami substancji organicznych wybucha.
Otrzymywanie
Kwas chlorowy można otrzymać przez dodanie kwasu siarkowego do wodnego roztworu chloranu baru (wytrąca się wtedy nierozpuszczalny siarczan baru):
- Ba(ClO
3)
2 + H
2SO
4 → BaSO
4↓ + 2HClO
3
Kwas chlorowy powstaje też jako produkt dysproporcjonowania kwasu podchlorawego. Można też otrzymać go przez rozpuszczenie w wodzie dwutlenku chloru:
- 2ClO
2 + H
2O → HClO
2 + HClO
3
Sole kwasu chlorowego
Sole kwasu chlorowego to chlorany. Są one silnymi utleniaczami. Najbardziej znany jest chloran potasu (tzw. sól Bertholleta).
Przypisy
- ↑ a b c Neil G.N.G. Connelly Neil G.N.G. i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 295, ISBN 978-0-85404-438-2 (ang.).
- ↑ CRC Handbook of Chemistry and Physics, William M.W.M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, s. 4-58, ISBN 978-1-4822-0867-2 (ang.).
- ↑ a b c d e f Chloric acid, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 4710 [dostęp 2016-02-21] (niem. • ang.).
- p
- d
- e
| Kwasy beztlenowe i ich analogi |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Kwasy tlenowe |
|
- Kategoria:Kwasy nieorganiczne