Bisulfit

Bisulfitni jon (IUPAC-preporučena nomenklatura: hidrogen sulfit) je jon HSO3−. Soli koje sadrže HSO3− jon se nazivaju bisulfitima, a takođe su poznate kao sulfitne lužine. Na primer, natrijum bisulfit je NaHSO3.[1][2]
Reakcije
Bisulfitne soli se tipično pripremaju reakcijom alkalnih rastvora sa viškom sumpor dioksida:
- SO2 + NaOH → NaHSO3
HSO3− je konjugovana baza sumporaste kiseline, H2SO3:
- H2SO3 ⇌ HSO3− + H+
Sumporasta kiselina se ne može izolovati. Ravnoteža koja je znatno konzistentnija sa spektroskopskom evidencijom je:
- SO2 + H2O ⇌ HSO3− + H+
HSO3− je slaba kiselina sa pKa od 6.97. Njena konjugovana baza je sulfitni jon, SO32−:
- HSO3− ⇌ SO32− + H+
Bisulfiti su redukujući agensi, kao što su i svi sulfiti i sumpor dioksid, koji sadrže sumpor u istom oksidacionom stanju (+4).
Struktura

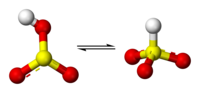
Eksperimentalni podaci sugerišu da je proton bisulfitnog jona lociran na sumporu, što mu daje C3v simetriju. Međutim isto tako postoje dokazi sa 17O NMR spektroskopije koji sugerišu da dve tautomerne forme HSO3− postoje u dinamičkoj ravnoteži, gde jedna ima C3v simetriju (protonacija sumpora) i druga Cs simetriju (protonacija kiseonika)[3]. C3v struktura je potvrđena kristalografski i, u rastvoru Ramanovom spektroskopijom (ν(S–H) = 2500 cm−1).
Medicina
Bisulfitne soli su uobičajeni aditivi leka epinefrin, gde sprečavaju oksidaciju u adrenohrom i rezultujuću inaktivaciju. Bisulfiti mogu u nekim slučajevima da izazovu alergijske reakcije.
Reference
- p
- r
- u
Alkohol • Aldehid • Alkan • Alken • Alkin • Amid • Amidin • Amin • Azo jedinjenje • Derivat benzena • Karboksil • Cijanat • Disulfid • Estar • Etar • Haloalkan • Hidrazon • Imid • Imin • Izocijanid • Izocijanat • Izonitril • Izotiocijanat • Karbamat • Keton • Organofosfor • Oksim • Nitril • Nitro • Nitrozo • Peroksid • Fosfonit • Fosfonat • Derivat piridina • Sulfon • Sulfonska kiselina • Sulfoksid • Tiocijanat • Tioestar • Tioetar • Tiol






