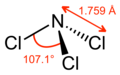Trichlorek azotu
| |||||||||||||||||||||||||
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny | NCl3 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | Cl3N | ||||||||||||||||||||||||
| Masa molowa | 120,36 g/mol | ||||||||||||||||||||||||
| Wygląd | żółta, oleista ciecz[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | 10025-85-1 | ||||||||||||||||||||||||
| PubChem | 61437 | ||||||||||||||||||||||||
| DrugBank | DB14645 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | PCl | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Trichlorek azotu, NCl
3 – nieorganiczny związek chemiczny z grupy halogenków azotu. Związek ten może też być traktowany jako pochodna amoniaku, w której wszystkie atomy wodoru zostały podstawione atomami chloru, stąd alternatywna nazwa trichloroamina. Jest silnie wybuchowy[3]. Powstaje m.in. w reakcji chloru z amoniakiem i stanowi istotne zagrożenie w instalacjach przemysłowych z chlorem – dla uniknięcia jego powstawania, konieczne jest zapewnienie braku kontaktu chloru ze związkami amonowymi[4].
Otrzymywanie
Po raz pierwszy został otrzymany w roku 1811 przez francuskiego chemika P. L. Dulonga. Zarówno on, jak i Humphry Davy oraz Michael Faraday odnieśli obrażenia w wyniku eksplozji podczas badań tego związku (Dulong stracił 3 palce)[5].
Typową metodą otrzymywania trichlorku azotu jest reakcja chloru z amoniakiem lub solami amonowymi[3][6]:
- NH
3 + 3Cl
2 → NCl
3 + 3HCl
Na skalę laboratoryjną związek ten można otrzymać przez elektrolizę nasyconego roztworu chlorku amonu – chlor wydzielający się na anodzie, reaguje z solą amonową[5]:
- NH
4Cl + 3Cl
2 → NCl
3 + 4HCl
Szkodliwość
Trichlorek azotu powstaje podczas dezynfekcji związkami chloru wody zanieczyszczonej substancjami zawierającymi azot (np. mocznikiem, jonami NH+
4 lub aminokwasami)[7] i jest główną przyczyną ostrego zapachu na pływalniach krytych[8]. Powoduje podrażnienia oczu i układu oddechowego oraz może wywoływać astmę[7]. W celu jego rozkładu można stosować naświetlanie światłem UV o λ ≈ 360 nm[8].
Przypisy
- ↑ a b c d e f David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-79, ISBN 978-1-4200-9084-0 (ang.).
- ↑ David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 9-51, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b Yasukazu Ura, Gozyo Sakata: Chloroamines. W: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley, s. 1–2.
- ↑ Peter Schmittinger: Chlorine. W: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley, s. 6, 71–80.
- ↑ a b Stanisław Tołłoczko, Wiktor Kemula: Chemia nieorganiczna z zasadami chemii ogólnej. Warszawa: PWN, 1954, s. 315.
- ↑ Handbook of Preparative Inorganic Chemistry. Georg Brauer (red.). Wyd. 2. T. 1. Nowy Jork, Londyn: Academic Press, 1963, s. 479.
- ↑ a b C. Schmalz, F.H. Frimmel, C. Zwiener. Trichloramine in swimming pools--formation and mass transfer. „Water Res”. 45 (8), s. 2681–2690, 2011. DOI: 10.1016/j.watres.2011.02.024. PMID: 21420139.
- ↑ a b Światło UV. Pływalnie i baseny. [dostęp 2013-01-06].
- p
- d
- e
| 1. Litowców | |
|---|---|
| 2. Berylowców |
|
| 3. Skandowców |
|
| 4. Tytanowców |
|
| 5. Wanadowców |
|
| 6. Chromowców |
|
| 7. Manganowców |
|
| 8. Żelazowców |
|
| 9. Kobaltowców |
|
| 10. Niklowców |
|
| 11. Miedziowców |
|
| 12. Cynkowców |
|
| 13. Borowców |
|
| 14. Węglowców |
|
| 15. Azotowców |
|
| 16. Tlenowców |
|
| 17. Fluorowców |
|