Zeotrop
Zeotrop (mieszanina zeotropowa) – taki układ ciecz–para, w którym skład ciekłej mieszaniny (roztworu) dwóch lub więcej związków chemicznych jest zawsze inny niż skład pary nasyconej, powstającej z tej cieczy. Na wykresach fazowych prężność pary–skład (izotermy) i temperatura–skład (izobary), ilustrujących warunki równowagi termodynamicznej, nie występują punkty ekstremalne, charakterystyczne dla azeotropów dodatnich i ujemnych[1]. Jest to konsekwencją występowania niewielkich odchyleń od prawa Raoulta, dotyczącego roztworów doskonałych.
Wśród układów zeotropowych wyróżnia się[2][3]:
- homozeotropy
- z nieograniczoną mieszalnością w fazie ciekłej
- z ograniczoną mieszalnością w fazie ciekłej, w których obszar współistnienia faz ciekłych nie łączy się z obszarem współistnienia cieczy i pary
- heterozeotropy, w których obszar współistnienia faz ciekłych łączy się z obszarem współistnienia cieczy i pary
-
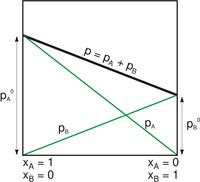 Prężność par A i B nad roztworem doskonałym
Prężność par A i B nad roztworem doskonałym -
 Niewielkie dodatnie odchylenia od prawa Raoulta
Niewielkie dodatnie odchylenia od prawa Raoulta -
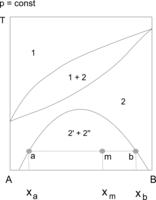 Zeotrop (homozeotrop) A–B oraz obszar współistnienia dwóch cieczy
Zeotrop (homozeotrop) A–B oraz obszar współistnienia dwóch cieczy
1 – para, 2 – ciecz, 2' i 2" – roztwory graniczne (ilości współistniejących faz określa reguła dźwigni) -
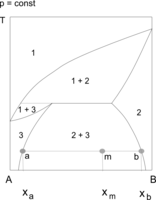 Heterozeotrop A–B
Heterozeotrop A–B
Układ z temperaturą równowagi trzech faz: pary (1) i dwóch cieczy (2 i 3)
Przypisy
- ↑ Zespół redaktorów Działu Słownictwa Technicznego WNT: Leksykon naukowo–techniczny z suplementem. Wyd. 4. T. A–O. Warszawa: Wydawnictwo Naukowo–Techniczne, 1989. ISBN 83-204-0967-5. (pol.).
- ↑ Antoni Basiński, Adam Bielański, Kazimierz Gumiński, i inni: Chemia fizyczna. Wyd. 3. Warszawa: Państwowe Wydawnictwo Naukowe, 1966. (pol.).
- ↑ Stanisław Bursa: Chemia fizyczna. Wyd. 2. Warszawa: Państwowe Wydawnictwo Naukowe, 1979. ISBN 83-01-00152-6. (pol.).













