Podtlenek węgla
| |||||||||||||||
 | |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny | C3O2 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 68,03 g/mol | ||||||||||||||
| Wygląd | bezbarwny gaz o ostrym zapachu | ||||||||||||||
| Identyfikacja | |||||||||||||||
| Numer CAS | 504-64-3 | ||||||||||||||
| PubChem | 136332 | ||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | tlenki węgla | ||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||
| |||||||||||||||
Podtlenek węgla (C3O2) – organiczny związek chemiczny z grupy tlenków węgla, dibezwodnik kwasu malonowego. W warunkach pokojowych jest trującym gazem[1].
Otrzymywanie
Podtlenek węgla został opisany po raz pierwszy w roku 1873 przez Benjamina Brodiego. Otrzymał go w postaci czerwonobrązowego nalotu na ściankach naczynia, w którym poddawał on działaniu prądu elektrycznego tlenek węgla[2][3]. Nazwę podtlenek węgla nadał mu Marcellin Berthelot[4].
Podtlenek węgla otrzymać można przez odwodnienie kwasu malonowego lub jego estrów za pomocą pięciotlenku fosforu[5][6][1]:
- CH
2(COOH)
2 + P
4O
10 → C
3O
2 + 4HPO
3
Przegląd jego metod otrzymywania i właściwości opublikowano w roku 1930[7].
Budowa
W cząsteczce podtlenku węgla wszystkie atomy są ułożone w linii prostej i połączone skumulowanymi podwójnymi wiązaniami chemicznymi: O=C=C=C=O.
Strukturę krystaliczną C3O2 ustalono w roku 2001 metodą rentgenograficzną w temperaturze −120 °C. Podtlenek węgla w takich warunkach tworzy kryształy w układzie rombowym, w których prawie idealnie liniowe cząsteczki O=C=C=C=O tworzą warstwy o układzie jodełki[6].
Właściwości chemiczne
Pod wpływem wody hydrolizuje do kwasu malonowego. Hydroliza z użyciem ciężkiej wody prowadzi do produktu zawierającego 4 atomy deuteru[8][9]:
- C
3O
2 + 2D
2O → CD
2(COOD)
2
Polimeryzacja
Podtlenek węgla ulega spontanicznej polimeryzacji, mogącej przebiegać wybuchowo, z uwolnieniem dużej ilości ciepła (136 kJ/mol). Produktem jest czerwono-czarne amorficzne ciało stałe, zachowujące wzór empiryczny C3O2[5][10].
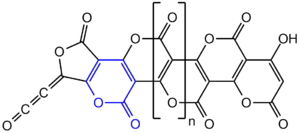
W roku 1960 Erich Ziegler na zjeździe Gesellschaft Deutscher Chemiker zaproponował policykliczną strukturę polimeru (C3O2)n zawierającą skondensowane pierścienie α-pironu (2H-piran-2-onu)[11], co zostało wkrótce potwierdzone w innych laboratoriach, jednak w roku 1984 struktura ta została zakwestionowana[10]. W roku 2004 opublikowane zostały badania rentgenograficzne (C3O2)n w roztworze dowodzące, że związek ten rzeczywiście zawiera jednostki α-pironu, a stopień polimeryzacji wynosi ok. n ≈ 40 (co jest niezgodne z wcześniejszymi wynikami n = 6–8 i wymaga potwierdzenia)[10]. Strukturę poli-α-pironu potwierdziły też analizy 13C NMR w ciele stałym[12].
Przypisy
- ↑ a b podtlenek węgla, [w:] Encyklopedia techniki. Chemia, WładysławW. Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 548, OCLC 33835352 .
- ↑ Note on the synthesis of marsh-gas and formic acid, and on the electric decomposition of carbonic oxide, „Proceedings of the Royal Society of London”, 21 (139–147), 1873, s. 245–247, DOI: 10.1098/rspl.1872.0052 [dostęp 2022-03-17] (ang.).
- ↑ B.C.B.C. Brodie B.C.B.C., Ueber eine Synthese von Sumpfgas und Ameisensäure und die electrische Zersetzung des Kohlenoxyds, „Justus Liebig’s Annalen der Chemie und Pharmacie”, 169 (1–2), 1873, s. 270–271, DOI: 10.1002/jlac.18731690119 [dostęp 2022-03-17] (niem.).
- ↑ MarcellinM. Berthelot MarcellinM., Action de la chaleur sur l’oxyde de carbone, „Annales de chimie et de physique”, 24, 6, 1891, s. 126–132 [dostęp 2022-03-17] (fr.).
- ↑ a b OttoO. Diels OttoO., BertramB. Wolf BertramB., Ueber das Kohlensuboxyd. I, „Berichte der deutschen chemischen Gesellschaft”, 39 (1), 1906, s. 689–697, DOI: 10.1002/cber.190603901103 [dostęp 2022-03-17] (niem.).
- ↑ a b A.A. Ellern A.A., T.T. Drews T.T., K.K. Seppelt K.K., The Structure of Carbon Suboxide, C3O2, in the Solid State, „Zeitschrift für anorganische und allgemeine Chemie”, 627 (1), 2001, s. 73–76, DOI: 10.1002/1521-3749(200101)627:1<73::AID-ZAAC73>3.0.CO;2-A (ang.).
- ↑ L.H.L.H. Reyerson L.H.L.H., Kenneth.K. Kobe Kenneth.K., Carbon Suboxide, „Chemical Reviews”, 7 (4), 1930, s. 479–492, DOI: 10.1021/cr60028a002 [dostęp 2022-03-17] (ang.).
- ↑ J.O.J.O. Halford J.O.J.O., Leigh C.L.C. Anderson Leigh C.L.C., Organic Deuterium Compounds. Acetic, Malonic and Succinic Acids, „Journal of the American Chemical Society”, 58 (5), 1936, s. 736–740, DOI: 10.1021/ja01296a011 [dostęp 2022-03-17] (ang.).
- ↑ F.F. Dalton F.F., R.D.R.D. Hill R.D.R.D., G.D.G.D. Meakins G.D.G.D., 590. The infrared spectra of deuterium compounds. Part I. The C–H stretching bands of OMe and NMe groups, „Journal of the Chemical Society”, 0 (0), 1960, s. 2927–2929, DOI: 10.1039/JR9600002927 [dostęp 2022-03-17] (ang.).
- ↑ a b c d MatthiasM. Ballauff MatthiasM. i inni, Analysis of Poly(carbon suboxide) by Small-Angle X-ray Scattering, „Angewandte Chemie International Edition”, 43 (43), 2004, s. 5843–5846, DOI: 10.1002/anie.200460263 [dostęp 2022-03-17] (ang.).
- ↑ Über die konstitutionellen Beziehungen ziuischen Polypyrono-Verbindungen und „der roten Kohle”, „Angewandte Chemie”, 72 (16), Hauptversammlung der Gesellschaft Deutscher Chemiker, 1960, s. 582, DOI: 10.1002/ange.19600721611 [dostęp 2022-03-17] (niem.).
- ↑ Jörn Schmedt auf derJ.S. Günne Jörn Schmedt auf derJ.S. i inni, The Structure of Poly(carbonsuboxide) on the Atomic Scale: A Solid-State NMR Study, „Chemistry – A European Journal”, 11 (15), 2005, s. 4429–4440, DOI: 10.1002/chem.200401133 [dostęp 2022-03-17] (ang.).
- GND: 4419344-0
- Britannica: science/carbon-suboxide











