Mentol
| | Nie mylić z: metol. |
| ||||||||||||||||||||||||||||||||
 Kryształy mentolu | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C10H20O | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 156,27 g/mol | |||||||||||||||||||||||||||||||
| Wygląd | białe lub bezbarwne, krystaliczne ciało stałe | |||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||
| Numer CAS | 89-78-1 (racemat) | |||||||||||||||||||||||||||||||
| PubChem | 16666 (izomer −) | |||||||||||||||||||||||||||||||
| DrugBank | DB00825 | |||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||
| Podobne związki | ||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
Mentol – organiczny związek chemiczny, alkohol z grupy terpenoidów, o ostrym, przenikliwym zapachu miętowym, stosowany masowo w przemyśle kosmetycznym i pomocniczych środkach farmaceutycznych.
Występowanie
Najpowszechniej naturalnie występującym izomerem jest (−)-mentol, czyli (1R,2S,5R)-5-metylo-(prop-2-ylo)cykloheksan-1-ol, który produkowany jest przez różne gatunki mięty. Olejek z mięty polnej zawiera go ok. 70–80%[6], jest też głównym składnikiem olejku miętowego z mięty pieprzowej[6][4], występuje także w wielu olejkach eterycznych innych roślin.
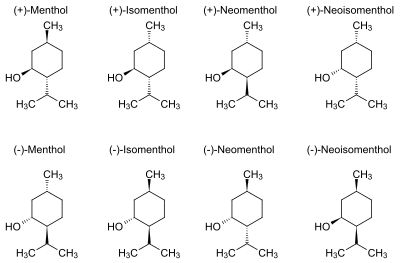
Inne izomery występujące w mniejszych ilościach w mięcie pieprzowej to (+)-neomentol (+)-izomentol i (+)-neoizomentol[7].
Otrzymywanie
Przemysłowo uzyskuje się go przez izolację z olejków z mięty polnej, pieprzowej i innych gatunków mięty oraz za pomocą syntezy chemicznej. Izolacja z olejku polega na schłodzeniu produktu i odwirowaniu wytrąconych kryształów[6].
Synteza chemiczna
Synteza asymetryczna (−)-mentolu prowadzona jest na skalę tysięcy ton przez japońską firmę Takasago International Corporation[8] przy użyciu metody opracowanej przez laureata Nagrody Nobla, Ryōjiego Noyoriego:

Właściwości
W temperaturze pokojowej tworzy białe, igłowe kryształki. Słabo rozpuszczalny w wodzie, dobrze rozpuszcza się w polarnych rozpuszczalnikach organicznych. Ze względu na to, że zawiera on 3 centra chiralności, ma 8 izomerów optycznych. Najczęściej spotykany (−)-mentol wykazuje najsilniejsze działanie biologiczne.
Mentol ulega reakcjom typowym dla alkoholi drugorzędowych, na przykład utlenianiu za pomocą trójtlenku chromu do ketonu (mentonu) lub ketokwasu karboksylowego, eliminacji do alkenu (3-mentenu) lub chlorowaniu za pomocą PCl
5 do chlorku mentylu:

Zastosowanie
Mentol ma własności znieczulające i zmniejszające podrażnienie błon śluzowych. Jego wdychanie lub spożywanie daje szybko odczuwalne wrażenie chłodu i świeżości. Jest stosowany w specyfikach wspomagających leczenie przeziębień i kataru. Jest też dodawany do maści na ból mięśni, aromatyzuje się nim chusteczki higieniczne, papierosy, tabaki, proszki do prania, płyny do mycia naczyń. Jest też stosowany jako jeden ze składników wielu kompozycji zapachowych stosowanych w kosmetyce. Zaaplikowany na dolną powiekę wywołuje łzawienie oczu, przez co znajduje zastosowanie w aktorstwie i modelingu.
W syntezie chemicznej mentol i jego pochodne wykorzystywane są jako pomocniki i katalizatory chiralne[9].
Zagrożenia
Mentol jest uważany za bezpieczny składnik produktów spożywczych, jednak w czystej formie jest substancja szkodliwą i odnotowano przypadki zatruć ostrych (objawy obejmują zapalenie skóry i warg, owrzodzenie jamy ustnej, ból brzucha, nudności, obrzęk mózgu, wymioty, bradykardię i dreszcze) spowodowanych spożyciem czystego olejku miętowego[4]. Do zatrucia może doprowadzić też spożycie dużych ilości lub produktów bogatych w mentol[4] lub długotrwałe przyjmowanie preparatów mentolowych[10]. Dawkę śmiertelną dla człowieka szacuje się na 50–150 mg/kg. W 2016 r. opisano pierwszy śmiertelny przypadek zatrucia mentolem, do którego doszło w wyniku wdychania oparów olejku miętowego podczas czyszczenia zbiornika na ten produkt[4].
Przypisy
- ↑ a b c d e f CRC Handbook of Chemistry and Physics, William M.W.M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 3-378, 6-75, ISBN 978-1-4987-5429-3 (ang.).
- ↑ a b c Menthol, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 17330 [dostęp 2024-03-07] (niem. • ang.).
- ↑ L-Mentol, karta charakterystyki produktu Sigma-Aldrich, Merck, 29 marca 2023, numer katalogowy: W266590 [dostęp 2024-03-07] . (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e AkshayA. Kumar AkshayA. i inni, A fatal case of menthol poisoning, „International Journal of Applied & Basic Medical Research”, 6 (2), 2016, s. 137–139, DOI: 10.4103/2229-516X.179015, PMID: 27127746, PMCID: PMC4830155 (ang.).
- ↑ Menthol [online], karta charakterystyki produktu Fisher Science Education, 8 maja 2015, numer katalogowy: S25751A [dostęp 2024-03-07] (ang.).
- ↑ a b c Karl-GeorgK.G. Fahlbusch Karl-GeorgK.G. i inni, Flavors and Fragrances, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 28–29, DOI: 10.1002/14356007.a11_141 (ang.).
- ↑ Paul M.P.M. Dewick Paul M.P.M., Medicinal Natural Products. A Biosynthetic Approach, wyd. 3, Wiley, 2009, s. 199, DOI: 10.1002/9780470742761, ISBN 978-0-470-74276-1 (ang.).
- ↑ Japan: Takasago to Expand L-Menthol Production in Iwata Plant, [w:] FlexNews [online], 10 stycznia 2008 [zarchiwizowane z adresu 2018-12-24] .
- ↑ RyszardR. Łaźny RyszardR., AnetaA. Nodzewska AnetaA., BeataB. Żabicka BeataB., Narzędzia chemii kombinatorycznej. Cz. 4. Synteza asymetryczna na fazie stałej, „Wiadomości Chemiczne”, 60 (3–4), 2006, s. 191–255 .
- ↑ MotazM. Baibars MotazM. i inni, Menthol toxicity: an unusual cause of coma, „Case Reports in Medicine”, 2012, 2012, s. 187039, DOI: 10.1155/2012/187039, PMID: 23251165, PMCID: PMC3521632 (ang.).
 Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
- Britannica: science/menthol
- Catalana: 0122789
- DSDE: mentol















