Drievoudige binding
Een drievoudige binding is in de scheikunde een type binding waarbij twee atomen verbonden zijn door middel van drie elektronenparen (6 bindingselektronen in totaal). De bindingsorde van een drievoudige binding is dus 3. De meest voorkomende drievoudige binding wordt gevonden bij alkynen, waarbij twee koolstofatomen zijn verbonden door middel van drie elektronenparen. Ook functionele groepen (cyaniden en isocyaniden) en diatomaire moleculen (distikstof en koolstofmonoxide) kunnen drievoudige bindingen bevatten.
 | 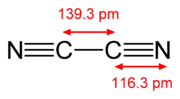 |  |
In structuurformules worden drievoudige bindingen aangeduid met 3 parallelle lijnen. De drie lijnen suggereren dat er sprake is van drie gelijke bindingen, maar dat is in de gebruikelijke beschrijving van deze bindingen niet het geval. Van deze drie bindingen is er namelijk eentje een sigma-binding, de andere twee zijn pi-bindingen. Omdat pi-bindingen zwakker zijn dan sigma-bindingen zijn (als gevolg van minder efficiënte orbitaaloverlap) de drie bindingen niet gelijk in bindingssterkte.












