ボラジン
| ボラジン | |
|---|---|
 |  |
ボラジン | |
別称 ボラゾール, 無機ベンゼン | |
| 識別情報 | |
| CAS登録番号 | 6569-51-3 |
| |
| 特性 | |
| 化学式 | B3N3H6 |
| モル質量 | 80.50 g/mol |
| 示性式 | (BH-NH)3 |
| 外観 | 無色の液体 |
| 密度 | 0.81 g/cm3 |
| 融点 | −58 °C |
| 沸点 | 55 °C |
| 危険性 | |
| NFPA 704 |  2 2 1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ボラジン (borazine) は、ホウ素と窒素、水素よりなる複素環式化合物である。IUPAC命名法ではシクロトリボラザン (cyclotriborazane) となる。
性質
融点 −58 ℃、沸点 55 ℃ の無色透明の芳香を持つ液体で、乾燥した大気下では安定。水と反応して水素、アンモニア、ホウ酸を生じる。また光により、水素を放出しながら緩やかに重合する。また熱、アルコールおよび酸によっても分解される。引火点が −1.7 ℃ のため、引火しやすく危険。
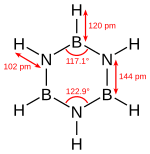
ボラジンは、ベンゼン同様に窒素とホウ素が3つずつ平面上に亀の甲(六角形)状に交互に配置した構造をとっており、炭素を含まないため、「無機ベンゼン」とも言われる。ホウ素の電子不足性と窒素の電子過剰性が補いあうのでベンゼンと等電子構造体であり、構造上安定とされていたが、実際には窒素とホウ素の電気陰性度が違うため正六角形にはならず(上の表を参照)、上記のように不安定である。環上に異なる原子が存在していることから部分的なイオン性を示し、低誘電率を示す。
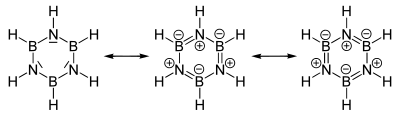
ボラジンには、下式のような共鳴構造が描かれる。
合成
1926年、ドイツのアルフレート・シュトックらによりジボランとアンモニアとの反応により初めて合成された。
水素化ホウ素リチウムと塩化アンモニウムから、より高い収率で合成される。
二段階による方法では、三塩化ホウ素をまずトリクロロボラジンに変える。続いて、水素化ホウ素ナトリウムにより還元し、塩素を水素へ置き換える。
利用
窒化ホウ素や低誘電率膜[1]の原料として重要。
関連項目
- 1,2-ジヒドロ-1,2-アザボリン(英語版) - ベンゼンの二つの炭素がホウ素と窒素に置換した化合物で、2008年に初めて合成された。
外部リンク
- 炭素をBNに置き換えると… - Chem-station
- 化学よもやま話(2017年春) - 東京化成工業









