Hukum gas gabungan
Hukum gas gabungan adalah suatu hukum gas yang menggabungkan hukum Charles,[1] hukum Boyle,[2] dan hukum Gay-Lussac.[3] Tidak ada pendiri resmi untuk hukum ini; hukum ini hanyalah sebuah penggabungan dari tiga hukum yang ditemukan sebelumnya. Hukum-hukum ini masing-masing menghubungkan satu variabel termodinamika ke variabel matematis lain sementara menjaga variabel yang lain tetap konstan.[4] Hukum Charles menyatakan bahwa volume dan suhu berbanding lurus satu sama lain selama tekanan tetap konstan. Hukum Boyle menegaskan bahwa tekanan dan volume berbanding terbalik satu sama lain pada suhu tetap. Akhirnya, hukum Gay-Lussac memperkenalkan proporsionalitas langsung antara suhu dan tekanan selama hal tersebut berlangsung pada volume konstan. Ketergantungan antar variabel ini ditunjukkan dalam hukum gas gabungan, yang dengan jelas menyatakan bahwa:
| “ | Perbandingan antara hasil kali tekanan-volume dan suhu pada suatu sistem bernilai konstan. | ” |
Hukum ini dapat dinyatakan secara matematis sebagai:
di mana:
- P adalah tekanan,
- V adalah volume,
- T adalah suhu yang diukur dalam satuan kelvin,
- k adalah suatu konstanta (dengan satuan energi dibagi dengan suhu).
Untuk membandingkan zat yang sama di bawah dua set kondisi yang berbeda, hukum dapat ditulis sebagai:
Penambahan hukum Avogadro pada hukum gas gabungan menghasilkan hukum gas ideal.
Penurunan dari hukum-hukum gas
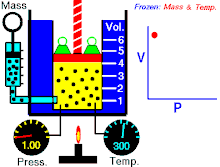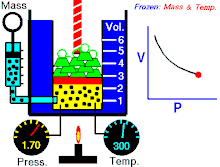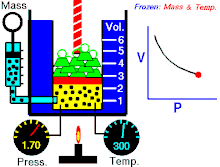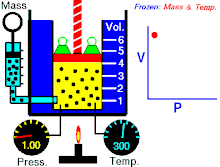


Hukum Boyle menyatakan bahwa hasil kali tekanan-volume bernilai konstan:
Hukum Charles menyatakan bahwa volume sebanding dengan suhu absolut:
Hukum Gay-Lussac menyatakan bahwa tekanan sebanding dengan suhu absolut:
Manipulasi aljabar tidak dapat dilakukan secara langsung karena Boyle melakukan eksperimen dengan suhu konstan, Charles melakukannya dengan tekanan konstan dan Lussac melakukannya dengan volume konstan, oleh karena itu interpretasi yang lebih tepat dari persamaan sebelumnya akan menjadi:
Dengan mengingat hal ini, untuk membawa penurunan rumus dengan benar, maka harus membayangkan gas diganggu oleh satu proses pada waktu tertentu - katakan diberikan terlebih dahuku pada Boyle untuk mengubah tekanan dan volume. Karena itu:
Setelah proses Boyle, gas memiliki:
- , &
Kemudian diberikan kepada Charles untuk mengubah volume dan suhu:
Setelah proses Charles, gas memiliki:
- , &
Kemudian akhirnya memberikannya kepada Lussac sehingga dapat mengubah tekanan dan suhu untuk mendapatkan:[5][6]
Setelah proses Lussac, gas memiliki:
- , &
Dari sini hanya aljabarnya saja:
- Dari Persamaan (4) diketahui bahwa:
mengganti nilai ke dalam Persamaan (5) diperoleh
Dan akhirnya mengganti nilai dari Persamaan (6) menjadi Persamaan (8) maka didapat:
yang disederhanakan menjadi:
- atau dengan kata lain: di mana k adalah suatu konstanta fisika.
Aplikasi
Hukum gas gabungan dapat digunakan untuk menjelaskan mekanika di mana tekanan, suhu, dan volume terpengaruh, misalnya pada pendingin ruangan, lemari es dan pembentukan awan. Hukum gas gabungan juga digunakan dalam mekanika fluida dan termodinamika.[7]
Lihat pula
Referensi
- ^ Fullick, P. (1994), Physics, Heinemann, hlm. 141–42, ISBN 0-435-57078-1
- ^ Draper, John William (1861). A Textbook on chemistry. hlm. 46.
- ^ Spurgin, CB (1987), "Gay-Lussac's gas-expansivity experiments and the traditional mis-teaching of 'Charles's Law'", Annals of Science, 44 (5): 489–505, doi:10.1080/00033798700200321
- ^ Raff, Lionel. (2001) Principles of Physical Chemistry. New Jersey: Prentice-Hall.
- ^ Gay-Lussac (1809) "Mémoire sur la combinaison des substances gazeuses, les unes avec les autres" (Memoir on the combination of gaseous substances with each other), Mémoires de la Société d'Arcueil 2: 207–234. Tersedia dalam Bahasa Inggris di: Le Moyne College.
- ^ "Joseph-Louis Gay-Lussac". chemistryexplained.com.
- ^ Batchelor, George K. (1967), An Introduction to Fluid Dynamics, Cambridge University Press, hlm. 74, ISBN 0-521-66396-2
Bacaan lebih lanjut
- Castka, Joseph F.; Metcalfe, H. Clark; Davis, Raymond E.; Williams, John E. (2002). Modern Chemistry. Holt, Rinehart and Winston. ISBN 0-03-056537-5.
- Guch, Ian (2003). The Complete Idiot's Guide to Chemistry. Alpha, Penguin Group Inc. ISBN 1-59257-101-8.
- Mascetta, Joseph A. (1998). How to Prepare for the SAT II Chemistry. Barron's. ISBN 0-7641-0331-8.
Pranala luar
- Applet Java interaktif mengenai hukum gas gabungan Diarsipkan 2011-08-13 di Wayback Machine. oleh Wolfgang Bauer



































