Oxyde d'or(III)
| Oxyde d'or(III) | |
 | |
| __ Au3+ __ O2−. | |
| Identification | |
|---|---|
| Nom UICPA | oxyde d'or(III) |
| Synonymes | sesquioxyde d'or |
| No CAS | 1303-58-8 |
| No ECHA | 100.013.748 |
| No CE | 215-122-1 |
| PubChem | 164805 |
| SMILES | [O-2].[O-2].[O-2].[Au+3].[Au+3] PubChem, vue 3D |
| InChI | Std. InChI : vue 3D InChI=1S/2Au.3O/q2*+3;3*-2 Std. InChIKey : DDYSHSNGZNCTKB-UHFFFAOYSA-N |
| Propriétés chimiques | |
| Formule | Au2O3 |
| Masse molaire[1] | 441,931 3 ± 0,000 9 g/mol Au 89,14 %, O 10,86 %, |
| Précautions | |
| SGH[2] | |
 Attention H315 : Provoque une irritation cutanée H319 : Provoque une sévère irritation des yeux P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. P337+P313 : Si l’irritation oculaire persiste : consulter un médecin. | |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
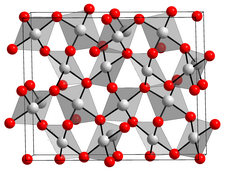
L'oxyde d'or(III), ou sesquioxyde d'or, est un composé chimique de formule Au2O3. C'est l'oxyde d'or le plus stable. Il s'agit d'un solide rouge brun cristallin semiconducteur[3] sensible à la lumière qui se décompose à 160 °C[4] en redonnant de l'or et de l'oxygène.
En raison de la nature peu réactive de l'or, l'oxyde d'or(III) ne peut être obtenu par réaction directe de l'oxygène O2 sur l'or dans des conditions normales. Il peut cependant être produit par réaction de l'or avec l'oxygène en milieu aqueux sous pression de plusieurs milliers d'atmosphères, ou avec de l'oxygène à l'état plasma. Des cristaux d'oxyde d'or(III) peuvent être obtenus à partir de l'oxyde d'or(III) hydraté amorphe par réaction avec l'acide perchlorique HClO4 et un perchlorate ClO4− de métal alcalin dans un tube à quartz scellé à une température d'environ 250 °C et une pression de l'ordre de 30 MPa.
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Fiche Sigma-Aldrich du composé Gold(III) oxide hydrate, consultée le 9 mars 2017.
- ↑ (en) Hongqing Shi, Ryoji Asahi et Catherine Stampfl, « Properties of the gold oxides Au2O3 and Au2O : First-principles investigation », Physical Review B, vol. 75, no 20, , article no 205125 (DOI 10.1103/PhysRevB.75.205125, Bibcode 2007PhRvB..75t5125S, lire en ligne)
- ↑ (en) P. G. Jones, H. Rumpel, E. Schwarzmann, G. M. Sheldrick et H. Paulus, « Gold(III) oxide », Acta Crystallographica Scetion B, vol. B35, no 6, , p. 1435-1437 (DOI 10.1107/S0567740879006622, lire en ligne)
v · m | |||
|---|---|---|---|
| Au(-I) |
| ||
| Au(I) |
| ||
| Au(II) |
| ||
| Au(I,III) |
| ||
| Au(III) |
| ||
| Au(V) |
| ||
v · m | |
|---|---|
| États divers |
|
| État d'oxydation +1 |
|
| État d'oxydation +2 |
|
| État d'oxydation +3 |
|
| État d'oxydation +4 |
|
| État d'oxydation +5 |
|
| État d'oxydation +6 |
|
| État d'oxydation +7 |
|
| État d'oxydation +8 |
|
| Sujets connexes |
|
 Portail de la chimie
Portail de la chimie  Portail des sciences des matériaux
Portail des sciences des matériaux









