Nitrate de gallium
| Nitrate de gallium | |||
 | |||
| Ions constitutifs du nitrate de gallium | |||
| Identification | |||
|---|---|---|---|
| Synonymes | trinitrate de gallium | ||
| No CAS | 13494-90-1 69365-72-6 (hydrate) | ||
| No ECHA | 100.033.453 | ||
| No CE | 236-815-5 | ||
| DrugBank | DB05260 | ||
| PubChem | 61635 | ||
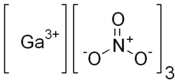
| SMILES | [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Ga+3] PubChem, vue 3D | ||
| InChI | Std. InChI : vue 3D InChI=1S/Ga.3NO3/c;3*2-1(3)4/q+3;3*-1 Std. InChIKey : CHPZKNULDCNCBW-UHFFFAOYSA-N | ||
| Apparence | poudre blanche[1] | ||
| Propriétés chimiques | |||
| Formule | GaN3O9 | ||
| Masse molaire[2] | 255,738 ± 0,004 g/mol Ga 27,26 %, N 16,43 %, O 56,31 %, | ||
| Propriétés physiques | |||
| T° fusion | 110 °C[3] (décomposition de l'hydrate solide) | ||
| T° ébullition | 85 °C[4] (solution aqueuse) | ||
| Solubilité | soluble dans l'eau, l'éthanol et l'éther diéthylique[1] | ||
| Précautions | |||
| SGH[4] | |||
   Danger H272 : Peut aggraver un incendie ; comburant H290 : Peut être corrosif pour les métaux H314 : Provoque de graves brûlures de la peau et des lésions oculaires H331 : Toxique par inhalation EUH071 : Corrosif pour les voies respiratoires P221 : Prendre toutes précautions pour éviter de mélanger avec des matières combustibles… P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P310 : Appeler immédiatement un CENTRE ANTIPOISON ou un médecin. P303+P361+P353 : En cas de contact avec la peau (ou les cheveux) : enlever immédiatement les vêtements contaminés. Rincer la peau à l’eau/se doucher. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. P371+P380+P375 : En cas d’incendie important et s’il s’agit de grandes quantités : évacuer la zone. Combattre l’incendie à distance à cause du risque d’explosion. | |||
| NFPA 704[4] | |||
0 4 0 | |||
| Transport[4] | |||
Numéro ONU : 3218 : NITRATES INORGANIQUES EN SOLUTION AQUEUSE, N.S.A. Étiquette :  5.1 : Matières comburantes Emballage : Groupe d'emballage III : matières faiblement dangereuses. | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
Le nitrate de gallium est un composé chimique de formule Ga(NO3)3. Il s'agit du sel de gallium et d'acide nitrique HNO3. Il se présente sous la forme d'une poudre blanche très soluble dans l'eau. Il en existe un hydrate Ga(NO3)3·x H2O, également sous forme d'une poudre blanche[1]. Il peut être obtenu par dissolution de gallium ou d'oxyde de gallium(III) Ga2O3 dans l'acide nitrique, suivie de dessication de l'hydrate obtenu à 40 °C[5].
-
 Nonahydrate de nitrate de gallium.
Nonahydrate de nitrate de gallium.
Le nitrate de gallium est utilisé en médecine pour traiter l'hypercalcémie secondaire induite par certains cancers. Il agit en inhibant l'activité des ostéoclastes, ce qui réduit le taux de calcium libre dans le sang résultant de la dégradation des os. Les atomes de gallium se lient aux groupes phosphate de l'ADN à faible concentration en formant des complexes stables[6]. L'affinité de l'ADN pour le gallium est sensiblement supérieure à celle du magnésium. Si l'interaction entre le métal et les bases de l'ADN n'a pas été observée, il est possible que le gallium inhibe la réplication de l'ADN en ciblant spécifiquement la ribonucléotide réductase[7]. De plus, on a montré que le gallium se lie à la transferrine plus fortement que le fer, et que le complexe gallium−transferrine inhibe la synthèse d'ADN en agissant sur la sous-unité M2 de la ribonucléotide réductase[8]. Le cation de gallium(III) Ga3+ pourrait agir comme antagoniste de plusieurs ions tels que Ca2+, Mg2+, Fe2+ et Zn2+ dans les processus du métabolisme cellulaire.
Notes et références
- ↑ a b et c (en) Dale L. Perry, Handbook of Inorganic Compounds, 2e éd., Taylor & Francis, 2011, p. 491. (ISBN 1-4398-1462-7)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Fiche Sigma-Aldrich du composé Gallium(III) nitrate hydrate, consultée le 31 janvier 2023.
FDS : (en) « Gallium(III) nitrate hydrate » [PDF], sur sigmaaldrich.com, Sigma-Aldrich, (consulté le ) - ↑ a b c et d « Fiche du composé Gallium(III) nitrate solution, Ga 9-10% w/w », sur Alfa Aesar (consulté le ).
- ↑ (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 1, Ferdinand Enke, Stuttgart, 1975, p. 862. (ISBN 3-432-02328-6)
- ↑ (en) Michael M. Hart, Clara F. Smith, Sidney T. Yancey et Richard H. Adamson, « Toxicity and Antitumor Activity of Gallium Nitrate and Periodically Related Metal Salts », Journal of the National Cancer Institute, vol. 47, no 5, , p. 1121-1127 (PMID 4330799, DOI 10.1093/jnci/47.5.1121, lire en ligne).
- ↑ (en) M. Manfait et P. Collery, « Étude in vitro par spectroscopie Raman de la conformation d'un ADN sous l'influence des ions magnésium et gallium », Magnesium-Bulletin, vol. 6, no 4, , p. 153-155.
- ↑ (en) David W. Hedley, Edith H. Tripp, Peter Slowiaczek, Graham J. Mann, « Effect of Gallium on DNA Synthesis by Human T-Cell Lymphoblasts », Cancer Research, vol. 48, no 11, , p. 3014-3018 (PMID 3259158, lire en ligne
 ).
).
v · m | |||
|---|---|---|---|
| Ga(I) |
| ||
| Ga(II) |
| ||
| Ga(III) |
| ||
 Portail de la chimie
Portail de la chimie













