Acétylène
| Acétylène | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
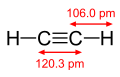
| Formule et structure 3D de l'acétylène. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | éthyne | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 74-86-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.000.743 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 200-816-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No RTECS | AO9600000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 6326 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 27518 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | C#C PubChem, vue 3D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI | InChI : vue 3D InChI=1S/C2H2/c1-2/h1-2H InChIKey : HSFWRNGVRCDJHI-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | gaz incolore dissous dans l'acétone sous pression[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C2H2 [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire[2] | 26,037 3 ± 0,001 7 g/mol C 92,26 %, H 7,74 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −80,7 °C (point triple)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | −84,7 °C[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | 1,185 g l−1 (eau, 20 °C)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | équation[5] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 305 °C[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | Gaz Inflammable[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air | 2,3–100 %vol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
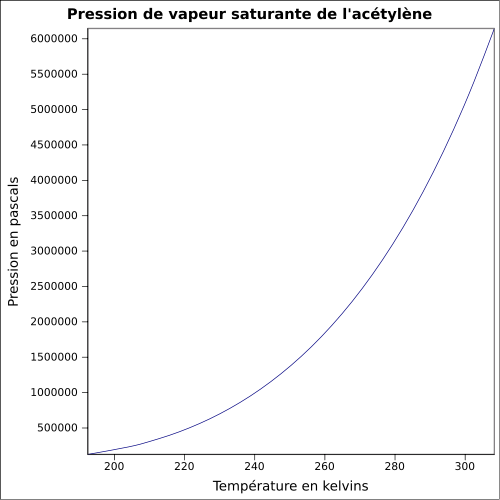
| Pression de vapeur saturante | à 20 °C : 4 460 kPa[1] équation[5] :
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 35,2 °C 61,38 bar 0,1122 l/mol[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | −80,8 °C à 1,282 5 bar[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S0gaz, 1 bar | 200,93 J mol−1 K−1 (1 bar)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ΔfH0gaz | 226,73 kJ mol−1[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp | 44,04 J mol−1 K−1 à 25 °C[8] équation[5] :
équation[9] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 1 301,1 kJ mol−1[10] (25 °C, gaz) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés électroniques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re énergie d'ionisation | 11,400 ± 0,002 eV (gaz)[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cristallographie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classe cristalline ou groupe d’espace | Pa3[12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Paramètres de maille | a = 6,140 Å b = 6,140 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume | 231,48 Å3[12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Danger H220 : Gaz extrêmement inflammable EUH006 : Danger d'explosion en contact ou sans contact avec l'air | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[14] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, B1, F, A : Gaz comprimé température critique = 36,3 °C B1 : Gaz inflammable limite inférieure d'inflammabilité = 2,5 % F : Matière dangereusement réactive sujet à une réaction violente de décomposition Divulgation à 1,0 % selon les critères de classification Consulter également la classification SIMDUT de l'acétylène dissous. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 0 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 239 : gaz inflammable, pouvant produire spontanément une réaction violente Numéro ONU : 1001 : ACÉTYLÈNE DISSOUS Classe : 2.1 Code de classification : 4F :Gaz dissous sous pression, inflammable ; Étiquette :  2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule);
Code Kemler : - Numéro ONU : 3374 : ACÉTYLÈNE SANS SOLVANT Classe : 2.1 Code de classification : 2F : Gaz liquéfié, inflammable ; Étiquette :  2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule); | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 0,37[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 226 ppm haut : 2 584 ppm[15] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L’acétylène (appelé éthyne par la nomenclature IUPAC) est un hydrocarbure de la classe des alcynes de formule brute C2H2. Il a été découvert par Edmund Davy en Angleterre en 1836. C’est l’alcyne le plus simple, constitué de deux atomes de carbone et deux d’hydrogène. Les deux atomes de carbone sont reliés par une triple liaison qui contient la majorité de son énergie chimique.
Description
Sa structure est linéaire : 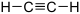 .
.
Il a été dit que Berthelot, en 1862, fut le premier à synthétiser l’acétylène, dans un appareil surnommé « œuf de Berthelot », par la production d'un arc voltaïque entre deux électrodes de graphite baignant dans une atmosphère d’hydrogène :
- 2 C + H2 → C2H2.
Toutefois, le professeur Morren, doyen de la faculté des sciences de Marseille, avait publié avant lui la découverte de la production de carbures dans un tel dispositif (et Berthelot se comporta d'ailleurs de façon honteuse vis-à-vis de ce collègue)[16].
L’acétylène est un gaz incolore, pratiquement inodore quand il est pur (mais on lui attribue généralement une odeur d'ail caractéristique qui provient des impuretés, notamment la phosphine lorsqu'il est produit à partir du carbure de calcium).
L'acétylène est extrêmement inflammable aux conditions normales de température et de pression. Il est endoénergétique par rapport au carbone et à l'hydrogène, et peut se décomposer spontanément, de façon explosive lorsque la pression est supérieure à 100 kPa, et jusqu'à quelques bars où cette décomposition spontanée se produit immanquablement[réf. souhaitée]. C'est pour cette raison qu’il est stocké dissous dans l’acétone ou le diméthylformamide (DMF), eux-mêmes inclus dans une matière poreuse stabilisatrice.
Utilisation
- La forte teneur en carbone donne une flamme très éclairante utilisée par exemple dans les lampes à acétylène (calebombe) des mineurs ou des spéléologues.
- La haute chaleur de combustion de l’acétylène permet d'atteindre de hautes températures (3 200 °C dans l'oxygène pur), ce qui en fait un candidat idéal comme combustible pour la soudure. Une des particularités de la combustion de l'acétylène est sa combustion en deux temps : l'acétylène réagit en premier avec l'oxygène pour donner du monoxyde de carbone et de l'hydrogène, puis ces produits réagissent dans un second temps pour former du dioxyde de carbone et de l'eau. Le monoxyde de carbone et l'hydrogène sont des gaz réducteurs, ce qui en fait des réactifs appréciés en soudure de l'acier pour réduire les oxydes de fer issus de la réaction entre le fer et l'oxygène à haute température, permettant ainsi une meilleure homogénéisation de la soudure et donc une meilleure qualité de cette dernière. La soudure à l'acétylène permet l'assemblage de métaux variés (aciers, inox, alliages de cuivre), mais aussi sous certaines conditions l'aluminium allié au silicium.
- L'acétylène est également utilisé comme combustible dans des appareils d'analyse. En effet, en spectrométrie d'absorption atomique (SAA), associé à différents comburants (air, oxygène pur, protoxyde d'azote), il permet l'ionisation d'éléments typiquement alcalino-terreux et d'en déterminer la concentration grâce à la loi de Beer-Lambert.
- L'acétylène est aussi utilisé dans les chalumeaux oxycoupeurs. Cependant, le propane lui est préféré, car moins coûteux. Mais pour les découpes de forte épaisseur, l'acétylène est indispensable pour chauffer suffisamment l'acier et initier l'oxycoupage sur une faible largeur.
- La réaction de l'acétylène avec l'acide chlorhydrique est une manière de produire du chlorure de vinyle (monomère du polychlorure de vinyle).

Propriétés physico-chimiques
Les propriétés chimiques de l'acétylène s'expliquent en grande partie par la présence dans sa molécule d'une triple liaison résultant de la superposition d'une liaison simple s (provenant de la fusion de deux orbitales sp) et de deux liaisons p résultant de la fusion de deux orbitales 2p. Cette liaison, de longueur 0,124 nm et caractérisée par une énergie de 811 kJ, est moins stable que les liaisons simples (614 kJ) et doubles (347,3 kJ), et par conséquent plus réactive.
Réactions de l'acétylène
- L’acétylène et les monoalkylacétylènes sont les seuls hydrocarbures qui ont un hydrogène ayant un caractère acide et qui peut être échangé par un métal :
- .
- Certains acétylénures comme sont détonants au choc.
- L’acétylène réagit avec l’acide cyanhydrique pour former de l’acrylonitrile, monomère de l’acrylonitrile butadiène styrène (ABS) et du styrène-acrylonitrile (SAN) :
- .
- L'acétylène donne le benzène par polymérisation sous l'action de la chaleur.
- Par dimérisation en présence de catalyseurs, on obtient du vinylacétylène auquel on ajoute du chlorure d'hydrogène pour obtenir du chloroprène, monomère du polychloroprène ou Néoprène.
Production et synthèse
L’acétylène n’existe pas à l'état naturel (d'autres alcynes existent ponctuellement dans les hydrocarbures). Les principales méthodes industrielles pour produire l’acétylène sont :
Méthode carbochimique
On utilise comme matière première le calcaire et le coke ou du charbon de bois. Dans un four à haute température (1 700 °C minimum) chauffé par un courant électrique passant dans le milieu réactionnel en fusion, il se produit du carbure de calcium selon les réactions :
- CaCO3 → CaO + CO2 ;
- CaO + 3 C + 108 300 cal → CaC2 + CO.
Chez l’utilisateur, le carbure réagit avec l’eau pour produire l’acétylène, 1 kg de carbure se combinant avec 562,5 g d’eau pour dégager 350 l d’acétylène[17] :
- CaC2 + 2 H2O → C2H2 + Ca(OH)2 + 31 000 cal.
Combustion partielle du méthane
La combustion partielle du méthane produit aussi de l’acétylène :
- 3 CH4 + 3 O2 → C2H2 + CO + 5 H2O.
Déshydrogénation des alcanes
Les alcanes les plus lourds du pétrole et du gaz naturel sont craqués en molécules plus légères qui sont déshydrogénées à haute température :
- C2H6 → C2H2 + 2 H2
- 2 CH4→ C2H2+ 3 H2
Cette dernière réaction est mise en œuvre dans le procédé de décomposition anaérobie du méthane par plasma micro-ondes[18]. L'intérêt de cette technologie est l'absence d'émission de CO2 et la production conjointe d'hydrogène en produit secondaire. Pour 32 t de méthane transformé, production de 26 t d'acétylène et 6 t d'hydrogène (selon la stoechiométrie).
Notes et références
- ↑ a b c et d ACETYLENE, Fiches internationales de sécurité chimique .
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a et b (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), chap. Physical Constants of Organic Compounds.
- ↑ a b et c Entrée « Acetylene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 14 avril 2009 (JavaScript nécessaire).
- ↑ a b et c (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- ↑ Clark, A.M. et Din, F., Equilibria Between Solid, Liquid, and Gaseous Phases at Low Temperature binary systems acetylene - carbon dioxide, acetylene - ethylene and acetylene - ethane, Trans. Faraday Soc., 1950, 46, 901.
- ↑ Tsonopoulos, C. et Ambrose, D., Vapor-Liquid Critical Properties of Elements and Compounds. 6. Unsaturated Aliphatic Hydrocarbons, J. Chem. Eng. Data, 1996, 41, 645-656.
- ↑ a b et c « Acetylene », sur webbook.nist.gov (consulté le ).
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub., (ISBN 0-88415-857-8, 978-0-88415-858-5 et 978-0-88415-859-2).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- ↑ a b et c « Acetylene », sur reciprocalnet.org (consulté le ).
- ↑ Numéro index 601-015-00-0 dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- ↑ « Acétylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009.
- ↑ « Acetylene », sur hazmap.nlm.nih.gov (consulté le ).
- ↑ Jean Jacques, Berthelot, 1827-1907 : autopsie d'un mythe, Belin, (OCLC 573258823, lire en ligne), chap. 7, p. 62.
- ↑ Philippe Nowak, « L’acétylène », Le P'tit Usania, no 7, mars 1999 (ISSN 1292-5950), USAN, Nancy, p. 1.
- ↑ (en-US) « How it Works », sur Transform Materials (consulté le )
Voir aussi
Articles connexes
Liens externes
- Fiche toxicologique FT 212, INRS
 Portail de la chimie
Portail de la chimie  Portail de l’énergie
Portail de l’énergie




















