Diazoniumsalze
| Diazoniumsalze (Auswahl) |
|---|
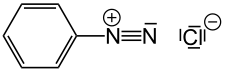 Phenyldiazoniumchlorid (aromatisches Diazoniumsalz) in Wasser bei 0 °C etwas haltbar |
 Methandiazoniumchlorid (aliphatisches Diazoniumsalz) sehr unbeständig |
Diazoniumsalze sind eine Stoffklasse organisch-chemischer Verbindungen mit der allgemeinen Strukturformel Ar–N2+ X−. Dabei steht Ar für eine organische, aromatische Arylgruppe und X− steht für ein nicht näher spezifiziertes Anion. Die einfachsten Vertreter dieser Stoffgruppe sind die bei niedrigen Temperaturen einigermaßen stabilen Phenyldiazonium-Salze. Aliphatische Diazoniumsalze sind instabil. Beim Erhitzen (Thermolyse) oder beim Bestrahlen (Photolyse) entstehen, unter Abspaltung von Stickstoff (N2), Carbene.[1]
Darstellung
Aromatische Diazoniumsalze lassen sich durch Diazotierung primärer aromatischer Amine mit Nitrit im sauren Milieu bei tiefer Temperatur darstellen.
Eigenschaften
Reine Diazoniumsalze sind instabil, teilweise explosiv und lassen sich nur in wässriger Lösung (bei Temperaturen < 5 °C) handhaben. Beim Versuch, die Salze wasserfrei zu erhalten zerfallen sie explosiv, lassen sich aber mit sterisch anspruchsvollen Anionen stabilisieren und dann isolieren.
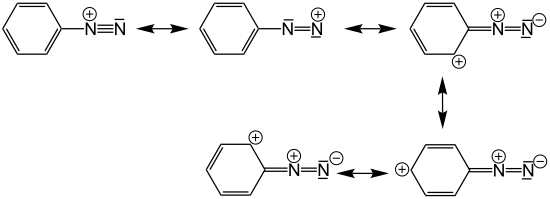
Aromatische Diazoniumsalze (hier das Phenyldiazonium-Kation) sind wegen der möglichen Mesomeriestabilisierung der positiven Ladung deutlich stabiler als aliphatische Diazoniumsalze:
Verwendung
- Aromatische Diazoniumsalze sind Zwischenprodukte bei der Synthese aromatischer Verbindungen durch den Angriff von Nucleophilen, z. B. bei der sogenannten Verkochung, bei der Phenole gebildet werden, oder bei der Sandmeyer-Reaktion, die zu halogenierten Aromaten oder zu aromatischen Nitrilen führt.
- Als schwach elektrophile Reagentien greifen aromatische Diazoniumkationen andere Aromaten an elektronenreichen Positionen an. Bei dieser Reaktion, der sogenannten Azokupplung, werden dann Azofarbstoffe gebildet.
- Bei der Diazotierung von chiralen α-Aminosäuren treten Diazoniumsalze als Zwischenprodukte auf, die in wässriger Lösung stereoselektiv zu α-Hydroxycarbonsäuren gleicher Konfiguration reagieren.
Einzelnachweise
- ↑ Siegfried Hauptmann: Organische Chemie, Verlag Harri Deutsch, 1985, S. 531, ISBN 3-87144-902-4.








